CRISPR / Cas: Heute Alltag in der Gentechnologie
Was ist CRISPR/Cas?
Die im Jahr 2012 entdeckte undheute alltäglich genutzte gentechnische Methode mit dem verschlungenen Namen CRISPR/Cas zählt zu den bedeutendsten Entdeckungen in der Geschichte der Lebenswissenschaften und unterstreicht die Wichtigkeit der Grundlagenforschung. Mit Hilfe des CRISPR/Cas-Systems lassen sich die Bausteine unseres Lebens einfach, gezielt und schnell verändern. So können Gene und regulatorische Erbgutabschnitte ohne grossen Aufwand ausgeschaltet oder ausgetauscht und neue Eigenschaften hinzugefügt werden. Da die CRISPR-Sequenzen in beinahe allen Lebewesen vorkommen, findet CRISPR/Cas eine breite Anwendung.
Bedeutung und Potenzial der Gentechnologie
Nicht nur Menschen, sondern auch Bakterien und Pflanzen können von Viren infiziert werden. Während wir unser Immunsystem zur Verteidigung nutzen, haben Bakterien einen ähnlich intelligenten Mechanismus entwickelt, um sich zu schützen und im Kampf gegen Viren als Sieger hervorzugehen. Bakterien integrieren nach einem Virusangriff Teile der Virus-Sequenzen in ihr eigenes Erbgut. Diese Sequenzen werden als CRISPR bezeichnet, was für Clustered Regularly Interspaced Short Palindromic Repeats steht. Wenn die gleichen Viren versuchen, das Bakterium erneut anzugreifen, bildet sich ein CRISPR/Cas-Komplex aus RNA-Molekülen, die kurze Kopien des Erbguts sind, und Cas-Proteinen, um den Angreifer zu zerstören. In diesem Kampf dienen die CRISPR-Sequenzen den Bakterien als Erkennungssignal, die Cas-Proteine als molekulare Scheren, um einen erneuten Angriff der Viren abzuwehren.
Eine grosse Entdeckung
Zusammen haben Emmanuelle Charpentier und Jennifer Doudna im Jahr 2012 herausgefunden, dass der CRISPR/Cas-Komplex für gentechnologische Zwecke verwendet werden kann. Martin Jinek ist Professor am Biochemischen Institut der Universität Zürich und hat als Postdoktorand im Labor von Jennifer Doudna gearbeitet. Er erklärt: «Als wir herausfanden, dass Cas9 DNA spezifisch schneiden kann und dieser Prozess von aussen beeinflusst werden kann, war uns klar, dass wir eine revolutionäre Entdeckung gemacht hatten». Obwohl es schon seit mehr als 20 Jahren möglich ist, das Erbgut gezielt zu verändern, waren bisherige Methoden wie Zink-Finger- oder TALEN-Nukleasen sehr teuer und aufwendig. Heute kann man mit CRISPR/Cas zum Beispiel ein Gen in einer Maus innerhalb weniger Wochen ausschalten, während dieser Prozess früher mehrere Monate dauerte.
Anwendungsmöglichkeiten von CRISPR/Cas
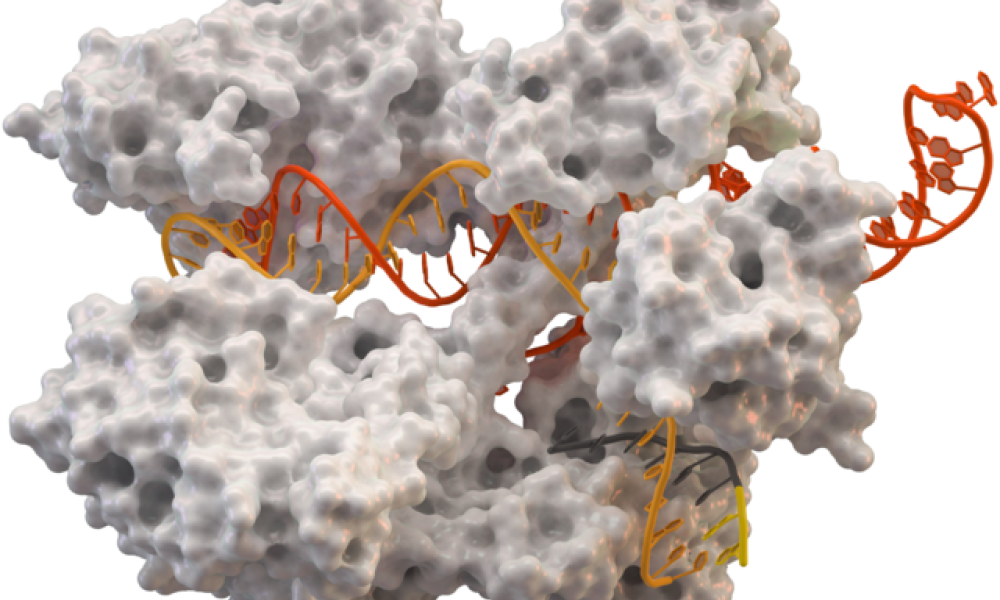
Um ein Gen mit CRISPR/Cas9 gezielt zu modifizieren, wird ein RNA-Stück von mindestens 18 Basen verwendet, das speziell für die gewünschte Stelle im Erbgut entworfen und später synthetisiert wird. Diese sogenannte Guide-RNA bildet zusammen mit dem Protein Cas9 eine Art molekulare Schere, die das Erbgut an der gewünschten Stelle durchtrennt. Dadurch entsteht ein Doppelstrangbruch und damit eine beabsichtigte Schädigung im Genom, die repariert werden muss. In menschlichen Zellen gibt es zwei verschiedene Reparaturmechanismen. Je nachdem, welche Veränderung im Erbgut vorgenommen werden soll, kann entweder der eine (homologe Rekombination) oder der andere (nichthomologe Rekombination) Mechanismus genutzt werden. Auf diese Weise können entweder Gene ausgeschaltet oder neue Sequenzen in das Erbgut eingeführt werden. Darüber hinaus können Fehler oder Mutationen im Erbgut korrigiert werden, indem die fehlerhafte Sequenz ausgetauscht wird.
CRISPR-veränderte Organismen sind keine GVO – oder doch?
CRISPR hat auch in der Pflanzenwissenschaft Einzug gehalten. Eine chinesische Forschergruppe hat bereits CRISPR/Cas verwendet, um mehltauresistenten Weizen herzustellen. Der komplexe Aufbau des Weizengenoms hat solche Anwendungen bisher verhindert. Im Gegensatz zum menschlichen Genom, das einen diploiden Chromosomensatz hat, besitzt Weizen einen hexaploiden Chromosomensatz. Das bedeutet, dass jedes Gen sechsmal vorhanden ist und daher sechsmal ausgeschaltet werden muss. Es laufen weitere Studien, um natürliche Resistenz in Grundnahrungsmitteln wie Reis und Maniok zu etablieren.
Interessanterweise unterscheiden sich mit CRISPR/Cas veränderte Pflanzen nicht von auf natürlichem Weg oder durch Mutagenese erzeugte Arten, sofern Gene eingebracht oder Mutationen angepasst werden, welche auch natürlich vorkommen. Ein Nachweis, auf welchem Weg eine Nutzpflanze hergestellt wurde, ist in diesem Fall im Nachhinein nicht möglich, da sich das Ergebnis nicht von herkömmlichen Züchtungsmethoden unterscheidet. Die EU-Kommission hat daher am 5. Juli 2023 entschiedendass geneditierte Pflanzen, die auch auf natürlichem Weg entstehen können, nichtals gentechnisch veränderte Organismen gelten sollen.
Ausblick auf die Zukunft der Gentechnologie mit CRISPR/Cas
CRISPR/Cas ist noch nicht perfekt. Es kann passieren, dass das System Stellen im Erbgut schneidet, die nicht geschnitten werden sollten. Diese Effekte werden als Off-Target-Effekte bezeichnet. Viele Labore arbeiten seit Jahren an diesem Problem und haben die Technologie immer spezifischer gemacht. Deutliche Verbesserungen wurden bereits mit einer künstlich hergestellten Variante des Cas9-Proteins erzielt. Neben den Off-Target-Effekten muss auch die Effizienz – zumindest für gentherapeutische Ansätze – gesteigert werden. Denn CRISPR/Cas schneidet nicht in allen Zellen gleich gut, sodass nur ein Teil der Zellen tatsächlich die gewünschte Änderung trägt. Für Ex-vivo-Behandlungen spielt dies jedoch keine Rolle. Hier entnimmt man den Zellen von Patienten, behandelt sie ausserhalb des Körpers mit CRISPR/Cas in einer Kulturschale und trennt dann die Zellen, die die gewünschte Veränderung tragen, von den nicht veränderten Zellen. Die ausgewählten Zellen werden dann vermehrt und anschliessend wieder in den Körper injiziert, was als autologe Transplantation bezeichnet wird.
Weitere Beiträge zum Thema
| 09.12.2023 | |
| 04.12.2023 | |
| 28.11.2023 |
